Ganciclovir Accord
Ultimo aggiornamento: 17/07/2024
Cos'è Ganciclovir Accord?
Ganciclovir Accord è un farmaco a base del principio attivo
Ganciclovir Sale Sodico, appartenente alla categoria degli
Antivirali e nello specifico
Nucleosidi e nucleotidi, esclusi gli inibitori della transcrittasi inversa. E' commercializzato in Italia dall'azienda
Accord Healthcare Italia S.r.l..
Ganciclovir Accord può essere prescritto con Ricetta OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile.
Ganciclovir Accord può essere prescritto con Ricetta OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile.
Confezioni
Ganciclovir Accord 500 mg polvere per concentrato per infusione 5 flaconcini
Informazioni commerciali sulla prescrizione
Titolare: Accord Healthcare S.L.U.
Concessionario: Accord Healthcare Italia S.r.l.
Ricetta: OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile
Classe: H
Principio attivo: Ganciclovir Sale Sodico
Gruppo terapeutico: Antivirali
ATC: J05AB06 - Ganciclovir
Forma farmaceutica: polvere per soluzione
Concessionario: Accord Healthcare Italia S.r.l.
Ricetta: OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile
Classe: H
Principio attivo: Ganciclovir Sale Sodico
Gruppo terapeutico: Antivirali
ATC: J05AB06 - Ganciclovir
Forma farmaceutica: polvere per soluzione
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Ganciclovir Accord? A cosa serve?
Ganciclovir Accord è indicato negli adulti e negli adolescenti di età pari o superiore a 12 anni per:
- il trattamento di pazienti immunocompromessi con malattia da citomegalovirus (CMV);
- la prevenzione della malattia da CMV in pazienti con immunosoppressione indotta da farmaci (per esempio dopo trapianto di organo o chemioterapia oncologica).
Ganciclovir Accord è anche indicato dalla nascita per:
- prevenzione della malattia da CMV mediante profilassi universale in pazienti con immunosoppressione indotta da farmaci (ad esempio dopo trapianto di organi o chemioterapia oncologica).
Devono essere prese in considerazione le linee guida ufficiali sull'uso appropriato degli agenti antivirali.
Posologia
Come usare Ganciclovir Accord: Posologia
Posologia
Trattamento della malattia da CMV
Pazienti adulti e adolescenti di età pari o superiore a 12 anni con funzionalità renale normale:
- Trattamento di induzione: 5 mg/kg somministrati mediante infusione endovenosa nell'arco di un'ora, ogni 12 ore per 14 - 21 giorni.
- Trattamento di mantenimento: il trattamento di mantenimento può essere somministrato ai pazienti immunocompromessi a rischio di recidiva. 5 mg/kg somministrati mediante infusione endovenosa nell'arco di un'ora, una volta al giorno per 7 giorni a settimana o 6 mg/kg una volta al giorno per 5 giorni a settimana. La durata del trattamento di mantenimento deve essere stabilita caso per caso. Si deve fare riferimento alle linee guida terapeutiche locali.
- Trattamento della progressione della malattia: è possibile sottoporre a ritrattamento con il regime terapeutico di induzione qualsiasi paziente che mostri progressione della malattia da CMV, sia in terapia di mantenimento o sottoposto a sospensione del trattamento con ganciclovir.
Popolazione pediatrica dalla nascita a <12 anni:
I dati pediatrici attualmente disponibili sono descritti nei paragrafi 5.1 e 5.2 ma non è possibile formulare raccomandazioni sulla posologia
Prevenzione della malattia da CMV usando terapia preventiva
Pazienti adulti e adolescenti di età pari o superiore a 12 anni con funzionalità renale normale:
Terapia di induzione: 5 mg / kg somministrati per infusione endovenosa per un'ora, ogni 12 ore per 7-14 giorni.
Terapia di mantenimento: 5 mg / kg somministrati per infusione endovenosa per un'ora, una volta al giorno per 7 giorni alla settimana o 6 mg / kg una volta al giorno per 5 giorni alla settimana. La durata della terapia di mantenimento si basa sul rischio di malattia da CMV, le linee guida sul trattamento locale devono essere consultate.
Popolazione pediatrica dalla nascita a <12 anni:
I dati attualmente disponibili sono descritti nei paragrafi 5.1 e 5.2 ma non è possibile formulare raccomandazioni sulla posologia.
Prevenzione della malattia da CMV usando la profilassi universale
Popolazione adulti e pediatrica > 16 anni:
5 mg / kg somministrati per infusione endovenosa per un'ora, una volta al giorno per 7 giorni alla settimana o 6 mg / kg una volta al giorno per 5 giorni alla settimana. La durata della profilassi si basa sul rischio di malattia da CMV, le linee guida sul trattamento locale devono essere consultate.
Popolazione pediatrica dalla nascita a ≤ 16 anni:
La dose giornaliera raccomandata di ganciclovir somministrata per infusione endovenosa per un'ora è basata su Body Surface Area (BSA) utilizzando la formula di Mostellar BSA e clearance della creatinina derivata dalla formula di Schwartz (CrCLS), ed è calcolata utilizzando le equazioni di seguito. La durata della profilassi universale si basa sul rischio di malattia da CMV e dovrebbe essere determinata su base individuale.
Dose pediatrica (mg) = 3 x BSA x CrCLS (vedere la formula Mostellar BSA e la formula di clearance della creatinina di Schwartz di seguito).
Se la clearance della creatinina di Schwartz è superiore a 150 ml / min / 1,73 m2, nell'equazione deve essere utilizzato un valore massimo di 150 ml / min / 1,73 m2:
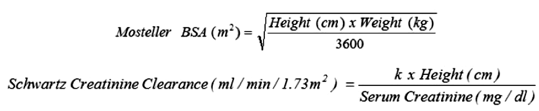
dove k = 0,33 per i pazienti di età <1 anno con basso peso alla nascita, 0,45 per pazienti di età <2 anni, 0,55 per ragazzi di età compresa tra 2 e <13 anni e ragazze di età compresa tra 2 e 16 anni, e 0,7 per ragazzi di età compresa tra 13 e 16 anni. Fare riferimento al dosaggio per adulti per pazienti di età superiore ai 16 anni.
I valori k forniti si basano sul metodo Jaffe per misurare la creatinina sierica e possono richiedere una correzione quando vengono utilizzati metodi enzimatici.
Si raccomanda di rivedere regolarmente i livelli sierici di creatinina, l'altezza e il peso e di modificare la dose secondo necessità.
Istruzioni per dosaggi speciali
Compromissione renale
I pazienti pediatrici (dalla nascita fino all'età di ≤ 16 anni) con insufficienza renale sottoposti a una dose profilattica di ganciclovir calcolato utilizzando l'algoritmo di dosaggio 3 x BSA x CrCLS non richiedono ulteriori modifiche della dose poiché questa dose è già aggiustata per la clearance della creatinina.
Per i pazienti di età pari o superiore a 12 anni con compromissione renale, trattati su base mg / kg di peso corporeo per la terapia preventiva e il trattamento della malattia da CMV, la dose mg / kg di ganciclovir deve essere modificata in base alla clearance della creatinina come mostrato nella tabella sottostante (vedere i paragrafi 4.4 e 5.2).
Modifiche della dose per pazienti con insufficienza renale sottoposti a dosaggio mg / kg:
|
ClCr
|
Dose di induzione
|
Dose di mantenimento
|
|
>70 ml/min
|
5,0 mg/kg ogni 12 ore
|
5,0 mg/kg/giorno
|
|
50-69 ml/min
|
2,5 mg/kg ogni 12 ore
|
2,5 mg/kg/giorno
|
|
25-49 ml/min
|
2,5 mg/kg/giorno
|
1,25 mg/kg/giorno
|
|
10-24 ml/min
|
1,25 mg/kg/giorno
|
0,625 mg/kg/giorno
|
|
<10 ml/min
|
1,25 mg/kg 3 volte alla settimana dopo emodialisi
|
0,625 mg/kg 3 volte alla settimana dopo emodialisi
|
La clearance della creatinina stimata può essere calcolata a partire dalla creatinina sierica applicando la seguente formula:
| Per soggetti di sesso maschile: |
(140 – età [anni]) x (peso corporeo [kg])
(72) x (0,011 x creatinina sierica [micromol/l])
|
Per soggetti di sesso femminile: 0,85 x valore per gli uomini
In pazienti con compromissione renale si raccomanda l'aggiustamento della dose; pertanto, i livelli di creatinina sierica o di clearance della creatinina stimata devono essere monitorati.
Compromissione epatica
La sicurezza e l'efficacia di Ganciclovir Accord non sono state studiate in pazienti con insufficienza epatica (vedere paragrafo 5.2).
Severa leucopenia, neutropenia, anemia, trombocitopenia e pancitopenia
Vedere paragrafo 4.4 prima di iniziare il trattamento.
Se durante la terapia con ganciclovir dovesse verificarsi una significativa riduzione della conta ematica, occorre valutare il trattamento con fattori di crescita ematopoietici e/o l'interruzione del trattamento (vedere paragrafi 4.4 e 4.8).
Anziani
Negli anziani non sono stati condotti studi sull'efficacia o sulla sicurezza di ganciclovir. Poiché l'avanzamento dell'età comporta una riduzione della funzionalità renale, ganciclovir deve essere somministrato a pazienti anziani sotto stretto controllo dello stato funzionale dei reni (vedere paragrafo 5.2).
Modo di somministrazione
Attenzione:
Ganciclovir deve essere somministrato mediante infusione endovenosa nell'arco di 1 ora a una concentrazione massima di 10 mg/ml. La somministrazione mediante iniezione endovenosa rapida o in bolo deve essere evitata dato il possibile incremento di tossicità di ganciclovir dovuto al raggiungimento di livelli plasmatici troppo elevati.
La somministrazione mediante iniezione intramuscolare o sottocutanea deve essere evitata poiché può provocare severa irritazione tissutale a causa del pH elevato (~11) delle soluzioni di ganciclovir (vedere paragrafo 4.8).
Non si devono superare il dosaggio, la frequenza e la velocità di infusione raccomandati.
Ganciclovir Accord è una polvere per soluzione per infusione. Dopo la ricostituzione, Ganciclovir Accord si presenta come una soluzione limpida e incolore, praticamente priva di particelle visibili.
L'infusione deve essere somministrata in una vena con un flusso ematico adeguato, preferibilmente utilizzando una cannula di plastica.
Per le istruzioni sulla ricostituzione del medicinale prima della somministrazione, vedere paragrafo 6.6.
Precauzioni da prendere prima della manipolazione o della somministrazione del medicinale:
Poiché ganciclovir è ritenuto potenzialmente teratogeno e cancerogeno per l'uomo, è necessario esercitare cautela durante la sua manipolazione (vedere paragrafo 6.6).
Controindicazioni
Quando non dev'essere usato Ganciclovir Accord
Ipersensibilità al principio attivo, a valganciclovir o a uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
Allattamento (vedere paragrafo 4.6).
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Ganciclovir Accord
Ipersensibilità crociata
Data la stretta somiglianza in termini di struttura chimica tra ganciclovir, aciclovir e penciclovir, è possibile che si sviluppi una reazione di ipersensibilità crociata a tali medicinali. Si deve pertanto esercitare cautela quando si prescrive Ganciclovir Accord a pazienti con ipersensibilità nota ad aciclovir o penciclovir (o ai relativi profarmaci, rispettivamente valaciclovir o famciclovir).
Mutagenicità, teratogenicità, cancerogenicità, fertilità e contraccezione
Prima di iniziare il trattamento col ganciclovir, i pazienti devono essere informati dei potenziali rischi per il feto. Negli studi animali, ganciclovir è risultato essere mutageno, teratogeno, aspermatogeno e cancerogeno, e ha compromesso la fertilità. Si ritiene probabile che ganciclovir causi l'inibizione temporanea o definitiva della spermatogenesi (vedere paragrafi 4.6, 4.8 e 5.3).
Ganciclovir deve essere pertanto considerato un potenziale agente teratogeno e cancerogeno per gli esseri umani, potenzialmente in grado di causare malformazioni congenite e neoplasie. Le donne in età fertile devono quindi adottare misure contraccettive efficaci durante il trattamento e per almeno 30 giorni dopo la sua interruzione. Gli uomini devono utilizzare contraccettivi di barriera durante il trattamento e per almeno 90 giorni dopo la sua interruzione, a meno che non vi sia l'assoluta certezza che la partner non sia a rischio di gravidanza (vedere paragrafi 4.6, 4.8 e 5.3).
L'uso di ganciclovir, soprattutto nella popolazione pediatrica, necessita di estrema cautela a causa della sua possibile cancerogenicità a lungo termine e della potenziale tossicità a livello riproduttivo. I benefici del trattamento devono essere attentamente valutati caso per caso e devono chiaramente superare i relativi rischi (vedere paragrafo 4.2). Fare riferimento alle linee guida terapeutiche.
Mielosoppressione
Ganciclovir Accord deve essere usato con cautela nei pazienti con emocitopenia preesistente o con anamnesi positiva per emocitopenia farmaco-correlata e nei pazienti sottoposti a radioterapia.
Nei pazienti trattati con ganciclovir sono state osservate severa leucopenia, neutropenia, anemia, trombocitopenia, pancitopenia e riduzione della funzionalità midollare. Il trattamento non deve essere iniziato nel caso in cui la conta assoluta dei neutrofili sia inferiore a 500 cellule/µl, la conta piastrinica sia inferiore a 25.000/µl oppure il livello di emoglobina sia inferiore a 8 g/dl, (vedere paragrafi 4.2 e 4.8).
Durante la terapia si raccomanda di effettuare il monitoraggio della conta completa delle cellule ematiche, piastrine comprese. Nei pazienti con compromissione renale può rendersi necessario un monitoraggio ematologico più frequente. Durante i primi 14 giorni di somministrazione si raccomanda di eseguire la conta leucocitaria (preferibilmente con formula differenziale) ogni secondo giorno; nei pazienti che presentano bassi livelli di neutrofili (< 1000 neutrofili/µl) al basale, che hanno sviluppato leucopenia nel corso della precedente terapia con altre sostanze mielotossiche o che presentano compromissione renale, questo monitoraggio deve essere effettuato quotidianamente.
Per i pazienti con severa leucopenia, neutropenia, anemia e/o trombocitopenia si raccomanda di utilizzare il trattamento con fattori di crescita ematopoietici e/o l'interruzione della terapia con ganciclovir (vedere paragrafi 4.2 e 4.8).
Compromissione renale
I pazienti con compromissione renale sono maggiormente esposti al rischio di tossicità (soprattutto ematologica). È necessaria una riduzione della dose (vedere paragrafi 4.2 e 5.2).
Uso con altri medicinali
Nei pazienti in terapia con imipenem-cilastatina e ganciclovir sono state riferite convulsioni. Ganciclovir non deve essere usato in concomitanza con imipenem-cilastatina, a meno che i potenziali benefici non superino i potenziali rischi (vedere paragrafo 4.5).
I pazienti trattati con ganciclovir e didanosina, medicinali dal noto effetto mielosoppressore o che incidono sulla funzionalità renale devono essere monitorati attentamente per rilevare eventuali segni di tossicità additiva (vedere paragrafo 4.5).
Eccipienti
Questo medicinale contiene 46 mg di sodio per dose da 500 mg. Un fattore da tenere in considerazione nei pazienti che seguono una dieta iposodica.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Ganciclovir Accord
Interazioni farmacocinetiche
Probenecid
Probenecid, somministrato unitamente a ganciclovir per via orale, ha determinato una riduzione statisticamente significativa della clearance renale di ganciclovir, con conseguente aumento clinicamente significativo dell'esposizione. Il medesimo effetto è previsto anche con la somministrazione concomitante di ganciclovir e probenecid per via endovenosa. Pertanto i pazienti che assumono contemporaneamente probenecid e Ganciclovir Accord devono essere strettamente monitorati per rilevare un'eventuale tossicità da ganciclovir.
Didanosina
Le concentrazioni plasmatiche di didanosina sono risultate costantemente aumentate quando è stato somministrato in concomitanza con ganciclovir. Con dosi somministrate per via endovenosa comprese tra 5 e 10 mg/kg/giorno è stato osservato un aumento dell'AUC di didanosina del 38-67%. Non si sono manifestati effetti clinicamente significativi sulle concentrazioni di ganciclovir. I pazienti devono essere attentamente monitorati per rilevare un'eventuale tossicità da didanosina (vedere paragrafo 4.4).
Altri antiretrovirali
Gli isoenzimi del citocromo P450 non rivestono alcun ruolo nella farmacocinetica di ganciclovir. Di conseguenza, non si prevedono interazioni farmacocinetiche con gli inibitori della proteasi e gli inibitori non nucleosidici della trascrittasi inversa.
Interazioni farmacodinamiche
Imipenem-cilastatina
In pazienti trattati con ganciclovir in associazione a imipenem-cilastatina sono state riferite convulsioni. Questi medicinali non devono essere usati in concomitanza, a meno che i potenziali benefici non superino i potenziali rischi (vedere paragrafo 4.4).
Zidovudina
Sia la zidovudina che il ganciclovir hanno la possibilità di causare neutropenia e anemia. Durante la somministrazione concomitante di questi medicinali può verificarsi un'interazione faramcodinamica. Alcuni pazienti potrebbero non tollerare la terapia concomitante a pieno dosaggio (vedere paragrafo 4.4).
Altre potenziali interazioni farmacologiche
La tossicità può risultare incrementata quando ganciclovir è somministrato in concomitanza con altri farmaci notoriamente mielosoppressori o associati a compromissione renale. Questi includono agenti anti-infettivi (quali dapsone, pentamidina, flucitosina, amfotericina B, trimetoprim/sulfametoxazolo), immunosoppressori (per esempio ciclosporina, tacrolimus, micofenolato mofetile), agenti antineoplastici (per esempio vincristina, vinblastina, doxorubicina e idrossiurea), nucleosidi (compresi zidovudina, stavudina e didanosina) e analoghi nucleotidici (inclusi tenofovir e adefovir). Pertanto, l'impiego concomitante di questi farmaci con ganciclovir deve essere preso in considerazione soltanto nel caso in cui i potenziali benefici superino i rischi (vedere paragrafo 4.4).
Popolazione pediatrica
Sono stati effettuati studi di interazione soltanto negli adulti.
Fertilità , gravidanza e allattamento
Fertilità
Un piccolo studio clinico su pazienti con trapianto renale trattati con Valcyte per profilassi da CMV per un periodo fino a 200 giorni ha dimostrato un impatto del valganciclovir / ganciclovir sulla spermatogenesi, con diminuzione della densità e motilità dello sperma misurate dopo il completamento del trattamento. Questo effetto sembra essere reversibile e circa sei mesi dopo l'interruzione di Valcyte, la densità media dello sperma e la motilità si sono ripristinate a livelli paragonabili a quelli osservati nei controlli non trattati.
Negli studi condotti sugli animali, ganciclovir ha compromesso la fertilità nei topi di sesso maschile e femminile e ha mostrato di inibire la spermatogenesi e di indurre atrofia testicolare in topi, ratti e cani a dosi considerate clinicamente rilevanti.
Sulla base di studi clinici e non clinici, si ritiene probabile che il ganciclovir possa causare inibizione temporanea o permanente della spermatogenesi umana (vedere paragrafi 4.4 e 5.3).
Gravidanza
Non è stata determinata la sicurezza di ganciclovir nelle donne in stato di gravidanza. Tuttavia, ganciclovir si diffonde rapidamente attraverso la placenta umana. Negli studi animali, ganciclovir è stato associato a tossicità a livello della riproduzione e teratogenicità (vedere paragrafi 4.4 e 5.3).
Ganciclovir non deve pertanto essere usato nelle donne in stato di gravidanza a meno che le necessità cliniche terapeutiche della madre non superino il potenziale rischio teratogeno per il feto.
Contraccezione negli uomini e nelle donne
A causa della possibile tossicità a livello della riproduzione e della potenziale teratogenicità, alle donne in età fertile deve essere raccomandato l'utilizzo di metodi contraccettivi efficaci durante il trattamento e per almeno 30 giorni dopo la sua interruzione. I pazienti di sesso maschile devono utilizzare contraccettivi di barriera durante il trattamento con ganciclovir e per almeno 90 giorni dopo la sua interruzione, a meno che non vi sia l'assoluta certezza che la partner non sia a rischio di gravidanza (vedere paragrafi 4.4 e 5.3).
Allattamento
Non è noto se ganciclovir sia escreto nel latte materno, ma tale possibilità, così come le conseguenti reazioni avverse gravi che potrebbero determinarsi nei neonati allattati con latte materno, non possono essere escluse. I dati ricavati dagli animali indicano che il ganciclovir è escreto nel latte dei ratti in allattamento. Pertanto durante il trattamento con ganciclovir l'allattamento con latte materno deve essere interrotto (vedere paragrafo 4.3).
Effetti sulla capacità  di guidare veicoli e sull'uso di macchinari
Ganciclovir potrebbe avere effetti significativi sulla capacità di guidare veicoli e usare macchinari (vedere paragrafo 4.8).
Effetti indesiderati
Quali sono gli effetti collaterali di Ganciclovir Accord
Riassunto del profilo di sicurezza
Poiché valganciclovir è un pro-farmaco di ganciclovir, è probabile che le reazioni avverse associate a valganciclovir si verifichino anche con ganciclovir. Sebbene ganciclovir per via orale non sia più disponibile, le reazioni avverse segnalate con il suo utilizzo si possono manifestare anche in pazienti trattati con ganciclovir per via endovenosa. Pertanto, la tabella delle reazioni avverse al farmaco comprende sia quelle riferite con ganciclovir per via orale/endovenosa sia quelle segnalate con valganciclovir.
Nei pazienti trattati con ganciclovir le reazioni avverse più gravi e comuni al farmaco sono state quelle ematologiche con neutropenia, anemia e trombocitopenia. Altre reazioni avverse ai farmaci sono riportate nella tabella di seguito.
La frequenza indicata nella tabella delle reazioni avverse deriva da una popolazione aggregata di pazienti con infezione da HIV (n = 1704) sottoposti a terapia di mantenimento con ganciclovir o valganciclovir.
Fanno eccezione agranulocitosi, granulocitopenia e reazione anafilattica, la cui frequenza è ricavata dall'esperienza post-marketing. Le reazioni avverse sono riportate in base alla classificazione MedDRA per sistemi e organi. Le categorie di frequenza sono definite secondo la seguente convenzione: molto comune (≥ 1/10), comune (≥ 1/100, < 1/10), non comune (≥ 1/1.000, < 1/100), raro (≥ 1/10.000, < 1/1.000) e molto raro (< 1/10.000).Il profilo globale di sicurezza di ganciclovir/valganciclovir è consistente nelle popolazioni con HIV e sottoposte a trapianto, eccetto per quanto concerne il distacco della retina, segnalato soltanto nei pazienti con HIV affetti da retinite da CMV. Tuttavia, sussistono alcune differenze nella frequenza di determinate reazioni. Ganciclovir per via endovenosa è associato a un minor rischio di diarrea rispetto a valganciclovir per via orale. Nei pazienti con HIV vengono segnalate con maggiore frequenza piressia, infezioni da candida, depressione, neutropenia severa (ANC < 500/µl) e reazioni cutanee. Nei pazienti sottoposti a trapianto d'organo viene segnalata più frequentemente disfunzione renale ed epatica
Tabella delle reazioni avverse
|
Infezioni e infestazioni:
|
|
|
Molto comune:
|
Infezioni da candida, ivi compresa candidosi orale
|
|
Infezione delle alte vie respiratorie
|
|
|
Comune:
|
Sepsi
|
|
Influenza
|
|
|
Infezione delle vie urinarie
|
|
|
Cellulite
|
|
|
Patologie del sistema emolinfopoietico:
|
|
|
Molto comune:
|
Neutropenia
|
|
Anemia
|
|
|
Comune:
|
Trombocitopenia
|
|
Leucopenia
|
|
|
Pancitopenia
|
|
|
Non comune:
|
Insufficienza midollare
|
|
Raro:
|
Anemia aplastica
|
|
Agranulocitosi*
|
|
|
Granulocitopenia*
|
|
|
Patologie del sistema immunitario:
|
|
|
Comune:
|
Ipersensibilità
|
|
Raro:
|
Reazione anafilattica*
|
|
Disturbi del metabolismo e della nutrizione:
|
|
|
Molto comune:
|
Calo dell'appetito
|
|
Comune:
|
Perdita di peso
|
|
Disturbi psichiatrici:
|
|
|
Comune:
|
Depressione
|
|
Stato confusionale
|
|
|
Ansia
|
|
|
Non comune:
|
Agitazione
|
|
Disturbo psicotico
|
|
|
Pensieri anomali
|
|
|
Allucinazioni
|
|
|
Patologie del sistema nervoso:
|
|
|
Molto comune:
|
Mal di testa
|
|
Comune:
|
Insonnia
|
|
Neuropatia periferica
|
|
|
Capogiri
|
|
|
Parestesia
|
|
|
Ipoestesia
|
|
|
Convulsioni
|
|
|
Disgeusia (alterazione del gusto)
|
|
|
Non comune:
|
Tremori
|
|
Patologie dell'occhio:
|
|
|
Comune:
|
Compromissione della visione
|
|
Distacco della retina
|
|
|
Mosche volanti nel vitreo
|
|
|
Dolore oculare
|
|
|
Congiuntivite
|
|
|
Edema maculare
|
|
|
Patologie dell'orecchio e del labirinto:
|
|
|
Comune:
|
Dolore all'orecchio
|
|
Non comune:
|
Sordità
|
|
Patologie cardiache:
|
|
|
Non comune:
|
Aritmie cardiache
|
|
Patologie vascolari:
|
|
|
Comune:
|
Ipotensione
|
|
Patologie respiratorie, toraciche e mediastiniche:
|
|
|
Molto comune:
|
Dispnea
|
|
Tosse
|
|
|
Patologie gastrointestinali:
|
|
|
Molto comune:
|
Diarrea
|
|
Nausea
|
|
|
Vomito
|
|
|
Dolore addominale
|
|
|
Comune:
|
Dispepsia
|
|
Flatulenza
|
|
|
Dolore all'addome superiore
|
|
|
Costipazione
|
|
|
Ulcerazione della bocca
|
|
|
Disfagia
|
|
|
Distensione addominale
|
|
|
Pancreatite
|
|
|
Patologie epatobiliari:
|
|
|
Comune:
|
Aumento dei livelli di fosfatasi alcalina ematica
|
|
Alterazione della funzionalità epatica
|
|
|
Aumento dei livelli di aspartato aminotransferasi
|
|
|
Aumento dei livelli di alanina aminotransferasi
|
|
|
Patologie della cute e del tessuto sottocutaneo:
|
|
|
Molto comune:
|
Dermatite
|
|
Comune:
|
Sudorazione notturna
|
|
Prurito
|
|
|
Eruzione cutanea
|
|
|
Alopecia
|
|
|
Non comune:
|
Cute secca
|
|
Orticaria
|
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo:
|
|
|
Comune:
|
Mal di schiena
|
|
Mialgia
|
|
|
Artralgia
|
|
|
Spasmi muscolari
|
|
|
Patologie renali e urinarie:
|
|
|
Comune:
|
Compromissione renale
|
|
Riduzione della clearance renale della creatinina
|
|
|
Aumento dei livelli di creatinina ematica
|
|
|
Non comune:
|
Ematuria
|
|
Insufficienza renale
|
|
|
Patologie dell'apparato riproduttivo e della mammella:
|
|
|
Non comune:
|
Infertilità maschile
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione:
|
|
|
Molto comune:
|
Affaticamento
|
|
Piressia
|
|
|
Comune:
|
Reazione in corrispondenza della sede di iniezione
|
|
Dolore
|
|
|
Brividi
|
|
|
Malessere
|
|
|
Astenia
|
|
|
Non comune:
|
Dolore toracico
|
* Le categorie di frequenza di queste reazioni avverse provengono dall'esperienza successiva all'immissione in commercio, mentre tutte le altre si basano sulla frequenza registrata nell'ambito delle sperimentazioni cliniche.
Descrizione di reazioni avverse selezionate
Neutropenia
Non è possibile prevedere il rischio di neutropenia in base al numero dei neutrofili prima del trattamento. Solitamente, la neutropenia insorge durante la prima o la seconda settimana del trattamento di induzione e dopo la somministrazione di una dose cumulativa ≤ 200 mg/kg. Di norma, la conta cellulare rientra nei valori normali 2-5 giorni dopo la sospensione del farmaco o la riduzione della dose (vedere paragrafo 4.4).
Neutropenia severa
Neutropenia severa è stata riportata più frequentemente nei pazienti HIV (14%) che ricevono terapia di mantenimento con valganciclovir, ganciclovir orale o intravenoso (n = 1704) rispetto ai pazienti con trapianto di organi che ricevono valganciclovir o ganciclovir orale. Nei pazienti che hanno ricevuto valganciclovir o ganciclovir orale fino al giorno100 dopo il trapianto, l'incidenza di neutropenia severa è stata rispettivamente del 5% e del 3%, mentre nei pazienti che hanno ricevuto valganciclovir fino al giorno 200 dopo il trapianto l'incidenza di neutropenia severa è stata del 10%.
Trombocitopenia
I pazienti con basse conte piastriniche (< 100.000/ml) al basale presentano un aumento del rischio di sviluppare trombocitopenia. I pazienti con immunosoppressione iatrogena, a causa del trattamento con immunosoppressori, sono esposti a un rischio più elevato di sviluppare trombocitopenia rispetto ai pazienti affetti da AIDS (vedere paragrafo 4.4). La trombocitopenia severa può essere associata a un sanguinamento potenzialmente letale.
Convulsioni
Nei pazienti in terapia con imipenem-cilastatina e ganciclovir sono state riferite convulsioni (vedere paragrafi 4.4 e 4.5).
Distacco della retina
Questa reazione avversa è stata segnalata soltanto in studi condotti su pazienti affetti da AIDS trattati con Ganciclovir Accord per retinite da CMV.
Reazioni in sede di iniezione
Nei pazienti trattati con ganciclovir si verificano comunemente reazioni in sede di iniezione. Per ridurre il rischio di irritazione tissutale locale, Ganciclovir Accord deve essere somministrato in base alle raccomandazioni riportate nel paragrafo 4.2.
Popolazione pediatrica
Sebbene non siano stati condotti studi formali di sicurezza su ganciclovir in bambini di età inferiore a 12 anni, ma in base all'esperienza con valganciclovir, un profarmaco di ganciclovir, il profilo di sicurezza del farmaco attivo risulta nel suo complesso simile tra pazienti pediatrici e pazienti adulti.
Sebbene la neutropenia insorga con maggiore frequenza nei pazienti pediatrici, in questa popolazione di soggetti non emerge alcuna correlazione tra neutropenia e reazioni avverse infettive.
Un rischio più elevato di citopenia nei neonati e nei bambini garantisce l'attento monitoraggio della conta ematica in questi gruppi di età (vedere paragrafo 4.4).
Per i neonati o lattanti con HIV/AIDS o infezione da CMV congenita sintomatica trattati con valganciclovir o ganciclovir sono disponibili soltanto dati limitati; tuttavia, il profilo di sicurezza sembra essere coerente con il profilo di sicurezza noto per valganciclovir/ganciclovir.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Ganciclovir Accord
Sintomi
Durante gli studi clinici e nel periodo successivo all'immissione in commercio sono stati riferiti casi di sovradosaggio di ganciclovir e.v. La maggior parte delle segnalazioni non era associata a reazioni avverse oppure includeva una o più delle reazioni avverse elencate di seguito:
- Tossicità ematologica: mielosoppressione comprendente pancitopenia, aplasia midollare, leucopenia, neutropenia, granulocitopenia.
- Epatotossicità: epatite, alterazione della funzionalità epatica.
- Tossicità renale: peggioramento dell'ematuria in un paziente con compromissione renale preesistente, insufficienza renale acuta, aumento dei livelli di creatinina.
- Tossicità gastrointestinale: dolore addominale, diarrea, vomito.
- Neurotossicità: tremore generalizzato, convulsioni.
Gestione
Dal momento che l'emodialisi abbassa le concentrazioni di ganciclovir, nei pazienti a cui viene somministrata una dose eccessiva di ganciclovir il ricorso all'emodialisi può essere utile per ridurre l'esposizione al medicinale (vedere paragrafo 5.2).
Altre informazioni su popolazioni particolari
Compromissione renale: si prevede che il sovradosaggio di ganciclovir possa determinare un aumento della tossicità renale nei pazienti con compromissione renale (vedere paragrafo 4.4).
Popolazione pediatrica
Nessuna informazione specifica disponibile
Scadenza
3 anni.
Dopo ricostituzione:
Per quanto riguarda il medicinale ricostituito, la stabilità chimica e fisica in uso è stata dimostrata per 12 ore alla temperatura di 25°C dopo dissoluzione con acqua per preparazioni iniettabili. Non refrigerare o congelare.
Da un punto di vista microbiologico, la soluzione ricostituita deve essere utilizzata immediatamente. In caso contrario, i tempi e le condizioni di conservazione in uso prima della somministrazione sono di responsabilità dell'utilizzatore.
Dopo la diluizione:
La stabilità chimica e fisica in uso è stata dimostrata per 24 ore alla temperatura di 2-8°C (non congelare).
Da un punto di vista microbiologico, la soluzione per l'infusione di Ganciclovir Accord deve essere utilizzata immediatamente. In caso contrario, i tempi di conservazione in uso e le condizioni di conservazione prima dell'uso rientrano nella responsabilità dell'utilizzatore e di norma non devono superare le 24 ore a 2-8°C, a meno che la ricostituzione e la diluizione non siano avvenute in condizioni asettiche controllate e convalidate.
Conservazione
Questo medicinale non richiede alcuna particolare condizione di conservazione.
Per le condizioni di conservazione dopo la ricostituzione e la diluizione del medicinale, vedere paragrafo 6.3.
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it